88 Mrd. $ wurden inzwischen weltweit mit dem COVID-19-Impfstoff Comirnaty erlöst. Damit zählt der Wirkstoff von BioNTech und Pfizer zu den kommerziell erfolgreichsten Medikamenten aller Zeiten. Mit dem Fortschreiten der endemischen Phase rückt nun wieder das eigentliche Kerngeschäft BioNTechs, nämlich die breite Pipeline an Krebstherapien, in den Mittelpunkt. Kann es dem Unternehmen gelingen, auf den noch nie dagewesenen Erfolg mit dem COVID-19-Impfstoff „noch einen draufzusetzen“?
Biopharma-Unternehmen können aus unserer Sicht grundsätzlich attraktive langfristige Beteiligungen darstellen, sofern Kultur, Eigentümerstruktur und Replizierbarkeit der Technologiebasis gegeben sind – auf diese Merkmale sind wir bereits in einem früheren Blog-Beitrag eingegangen. Das Mainzer Unternehmen erfüllt diese Kriterien.

Bisher haben wir unsere Beteiligung an BioNTech hauptsächlich über Stillhaltergeschäfte monetarisiert. Wir veräußerten Put-Optionen und vereinnahmten dadurch Optionsprämien. Dies war opportun, da die Marktbewertung von BioNTech in den letzten Jahren häufig nur geringfügig über (und teilweise sogar unter) den liquiden Mitteln des Unternehmens lag. Gleichzeitig wiesen Optionen auf die BioNTech-Aktie zeitweise sehr hohe implizite Volatilitäten auf. Dadurch konnten wir Put-Optionen mit Ausübungspreisen um das Niveau der liquiden Mittel auf der Bilanz veräußern und dabei sehr hohe Prämien vereinnahmen. Im Detail sind wir auf diesen Ansatz im 34. Quartalsbericht und in diesem Blogbeitrag eingegangen. Heute beginnt sich diese Anomalie mit dem Durchscheinen der Werthaltigkeit der Onkologie-Pipeline langsam aufzulösen. Doch wie lässt sich dieses Potenzial einschätzen?
Das zentrale Dogma der Biologie
Um BioNTechs Pipeline besser zu verstehen, ist es hilfreich, die grundlegenden Wirkmechanismen von Medikamenten und der zugrunde liegenden Biologie zu betrachten. Das zentrale Dogma der Biologie besagt, dass die genetische Information in unserer DNA zuerst in mRNA („messenger RNA“) transkribiert und auf Basis dieser Vorlage dann im Ribosom in die verschiedenen Proteine übersetzt wird:
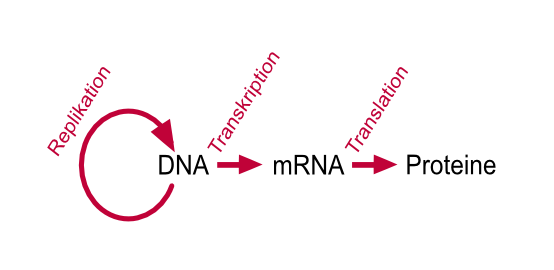
Vereinfacht gesagt verfügt menschliche DNA über rund 20.000 Gene, die entsprechend 20.000 individuelle Proteine codieren.1Die finale Anzahl an Proteinformen übersteigt diese Zahl durch Prozesse wie alternatives Spleißen und posttranslationale Modifikationen um ein Vielfaches. Proteine sind die essenziellen Bausteine in unseren Zellen und an nahezu allen biologischen Prozessen beteiligt. Sie agieren beispielsweise als Enzyme zur Beschleunigung biochemischer Reaktionen, als Transporter wie etwa Hämoglobin im Blut oder als Signalgeber, beispielsweise in Form von Insulin. Auch in unserem Immunsystem nehmen Proteine insbesondere in Form von Antikörpern eine zentrale Rolle ein. Aus diesem Grund zielt der Wirkungsmechanismus von Medikamenten in der Regel auf Proteine ab. Wirkstoffe werden so konzipiert, dass sie je nach Krankheit die Struktur eines Proteins verändern, dieses blockieren oder die Anzahl an Proteinen verändern können.
Von kleinen weiße Pillen und großen Proteinen
Das Arsenal der Pharma-Branche kann dabei in sogenannte Medikamenten-Modalitäten unterteilt werden. Darunter versteht die biopharmazeutische Industrie die grundlegende Kategorie oder Technologie, auf der ein Medikament basiert. Diese reichen von Small Molecules, die in Zellen eindringen können, über Antikörper, die sich an andere Proteine außerhalb von Zellen heften können, bis hin zu modernen Gen- und Zelltherapien.

Heute sind vor allem Small Molecules und Biologika wie Antikörper kommerziell von Bedeutung. Ein alltägliches Beispiel für erstere ist Aspirin: Dieses bindet sich an das deutlich größere Enzym Cyclooxygenase (ein Protein) und hemmt so die Bildung schmerzauslösender Botenstoffe.

Die in der Regel in Tablettenform oral eingenommenen Small Molecules haben ihren Namen nicht von ungefähr: Die Moleküle sind in der Regel nur rund 500 Dalton schwer, im Vergleich dazu kommen komplexe Biologika wie therapeutische Antikörper auf das dreihundertfache Gewicht. Im Gegensatz zu Small Molecules weisen die via Injektion verabreichten Antikörper eine höhere Spezifität auf und können so manipuliert („engineered“) werden, dass sie beispielsweise nach dem Schlüssel/Schloss-Prinzip bestimmte Proteine auf Krebszellen binden und helfen, diese zu zerstören. Dies ist schon längst nicht mehr Science-Fiction: Therapeutische Antikörper haben über die letzten drei Jahrzehnte die Krebstherapie revolutioniert. Der erste große Erfolg kam mit dem Antikörper Herceptin (Trastuzumab; Roche) kurz vor der Jahrtausendwende. Dieser Antikörper heftet sich an das Protein human epidermal growth factor receptor 2 (kurz: HER2), welches in erhöhten Mengen auf gewissen Brustkrebszellen zu finden ist und dort Signale für eine Beschleunigung der Zellteilung aussenden kann. Die Wirkungsweise von Herceptin besteht im „Andocken“ des Antikörpers an den HER2-Rezeptor auf der Krebszelle, wodurch zum einen die vom Rezeptor ausgehenden Signale zum Zellwachstum unterdrückt und zum anderen T-Zellen2Insbesondere zytotoxische T-Zellen, auch CD8-Lymphozyten genannt. zur Eliminierung der Krebszelle rekrutiert werden.

Antikörper können also eine wichtige Rolle in Krebstherapien spielen. Auch für BioNTech stellen sie eine zentrale Modalität dar. Komplementär dazu ist die mRNA-Technologie anzusehen, die bereits beim COVID-19-Impfstoff erfolgreich eingesetzt wurde.
Die Zelle als Impfstoffproduzent
Schon vor Ausbruch der COVID-19-Pandemie war BioNTech als mRNA-Spezialist bekannt. Einige der Medikamente in der Onkologie-Pipeline des Unternehmens basieren auch auf diesem Ansatz. Am Beispiel des COVID-19-Impfstoffs lassen sich die Vorteile mRNA-basierter Medikamente veranschaulichen.

Das SARS-CoV-2 Virus dringt mittels des sogenannten „Spike Proteins“ in menschliche Zellen ein. Der auf mRNA basierende Impfstoff Comirnaty macht sich diese Eigenschaft zunutze, indem die mRNA (also die „Bauanleitung“) für das Spike-Protein3Eingebettet in einem Lipid-based nanoparticle (LNP). des Virus via Injektion in unsere Zellen geliefert wird. Diese produzieren dann auf Basis dieser mRNA das Spike-Protein, woraufhin das Immunsystem beginnt, Antikörper gegen den „Eindringling“ zu produzieren und T-Zellen aktiviert. Im Falle einer Infektion heften sich die so generierten Antikörper an das Virus, um ein Ausbreiten zu verhindern, während die T-Killerzellen virusinfizierte Zellen eliminieren.
Herkömmliche Impfstoffe nutzen oft abgeschwächte oder abgetötete Krankheitserreger, um das Immunsystem zu stimulieren. Obwohl das Risiko sehr gering ist, können bei diesen Impfstoffen in seltenen Fällen leichte Nebenwirkungen auftreten. mRNA-Impfstoffe hingegen enthalten nur die Bauanleitung, um das an sich harmlose Spike-Protein im Körper selbst herzustellen. Dadurch wird das Immunsystem aktiviert, ohne dass ein vollständiger Virus in den Körper gelangt. Diese Technologie ermöglicht auch eine schnelle Entwicklung und Anpassung von Impfstoffen an neue Virusvarianten.
Die mRNA-Technologie von BioNTech ermöglicht es also, spezifische Proteine direkt im Körper des Patienten zu erzeugen. Die „Krebsimpfstoffe“ aus dem Hause BioNTech versuchen, nach derselben Logik das Immunsystem des Patienten im Kampf gegen den Tumor zu unterstützen. Es war jedoch lange Zeit umstritten, ob dieser Art der Immuntherapie überhaupt ein fundiertes biologisches Konzept zugrunde liegt.
Krebs und unser Immunsystem
Bis in die frühen 2010er Jahre war die Wirksamkeit von Immuntherapien gegen Krebs ein kontroverses Thema. Die Kernfrage lautete, weshalb sich das körpereigene Immunsystem der feindlichen Tumore nicht von selbst entledigt. Da Krebszellen grundsätzlich körpereigenen Ursprungs sind, bestanden Zweifel, ob das Immunsystem Krebszellen überhaupt als solche erkennen kann. Erst mit der Entdeckung sogenannter Immuncheckpoints (Proteinen wie CTLA-4 und PD-1) kam Licht ins Dunkel: Diese sind natürliche Regulatoren, die eine Überreaktion des Immunsystems verhindern sollen. Sie agieren wie „Bremsen“ des Immunsystems, die sicherstellen, dass T-Zellen nicht gesunde Zellen angreifen. Wie sich herausstellte, machen sich viele Krebszellen genau diesen Mechanismus zu Nutze, indem große Mengen an Proteinen wie PD-L1 ausgewiesen werden, um das Immunsystem zu unterdrücken und einer Immunüberwachung zu entkommen: PD-L1 bindet den komplementären PD-1-Rezeptor auf T-Zellen. Diese Bindung signalisiert der T-Zelle, ihre Aktivität zu reduzieren, wie auf der linken Darstellung in der untenstehenden Grafik veranschaulicht.
Sobald die moderne Medizin ein biologisches Problem verstanden hat, kann ein gezielter Wirkstoff entwickelt werden: In diesem Fall monoklonale Antikörper, die sich wie ein Keil zwischen die Immuncheckpoints auf Krebs- und T-Zellen setzen und somit die Immunblockade verhindern, wie die schematische Darstellung auf der rechten Seite zeigt:
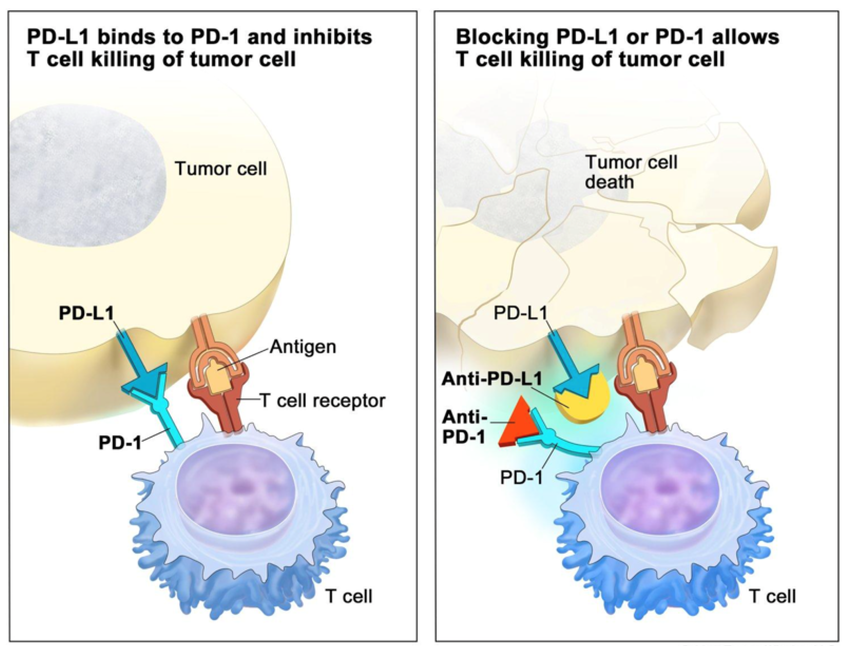
Auf diese Weise aktivieren – man könnte auch sagen: befreien – passende Antikörper das Immunsystem, sodass es gegen die Tumorzellen vorgehen kann. Die untenstehende Grafik zeigt die grundsätzlich vorhandene Effektivität von T-Killerzellen gegen Krebszellen:

Dieser Ansatz der Checkpoint-Blockade hat zu einem Paradigmenwechsel in zahlreichen Krebstherapien geführt und die Überlebenswahrscheinlichkeit selbst für viele Patienten mit metastasiertem Krebs signifikant erhöht. Die untenstehende Grafik zeigt die Überlebenswahrscheinlichkeit von Patienten mit einer Art von fortgeschrittenem Lungenkrebs bei Behandlung mit Chemotherapie allein (rot) und mit einer Kombination aus Chemotherapie und dem PD1-Checkpoint-Inhibitor Keytruda (Pembrolizumab; Merck) in blau:
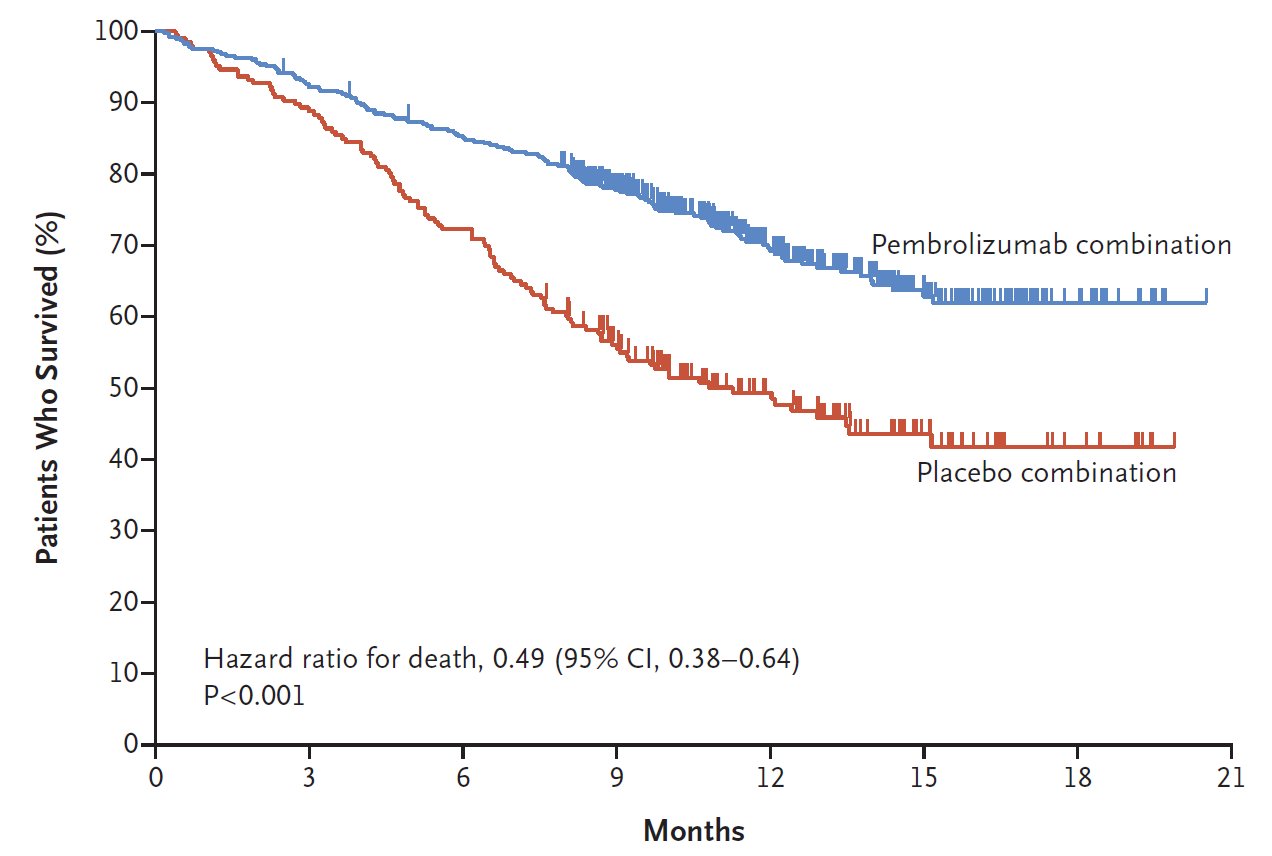
Solche eindeutigen Ergebnisse waren in der Onkologie zuvor selten und sorgen auch für einen entsprechenden kommerziellen Erfolg: Der führende anti-PD1-Antikörper Keytruda von Merck verbuchte im Jahr 2023 mehr als 25 Mrd. $ Umsatz, was den Wirkstoff zu einem der erfolgreichsten Medikamente überhaupt macht. Diese Zahlen sind nicht nur aufgrund ihrer absoluten Höhe imposant, sondern auch, weil bisher nur ein Teil der Patienten auf diese Art der Checkpoint-Blockade anspricht. Neue und verbesserte Ansätze können also einen enormen Nutzen stiften. Genau das hat sich BioNTech auf die Fahne geschrieben: Dem körpereigenen Immunsystem mit innovativen Medikamenten zu helfen, Krebs erfolgreich zu bekämpfen. Das Unternehmen entwickelt dazu eine Reihe therapeutischer Ansätze, die sich im Idealfall auch synergistisch kombinieren lassen.
Kombinationspotenzial innovativer Medikamente
BioNTech konnte die Pipeline an Medikamenten in der klinischen Entwicklung, die also bereits in den Phasen I bis III an menschlichen Probanden untersucht werden, seit dem Erfolg mit dem COVID-19-Impfstoff rapide ausbauen. Das Unternehmen finanziert aus den COVID-19-Erlösen die intern entwickelten Kandidaten und erweitert durch gezielte Übernahmen und Einlizenzierungen die Pipeline um neue Technologien. Die Vision lautet, neuartige Technologien wie Immunmodulatoren (insbesondere Checkpoint-Inhibitoren), mRNA-Krebsimpfstoffe und zielgerichtete Krebstherapien (wie etwa Antibody-Drug-Conjugates und Zelltherapien) synergistisch im Kampf gegen Krebs zu kombinieren. Die in der Grafik rot hervorgehobenen Programme stellen die aktuell aussichtsreichsten Einzelkandidaten aus diesen drei Kategorien dar und werden im Folgenden genauer beleuchtet.
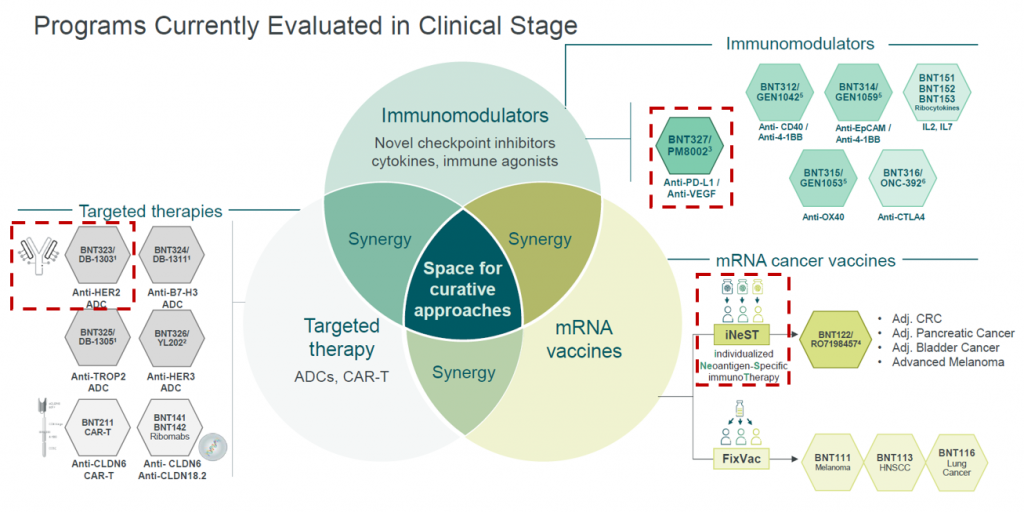
iNeST (individualisierte mRNA-Krebsimpfstoffe)
BioNTech wurde als Spezialist für mRNA bekannt. Im Bereich der Onkologie arbeitet das Unternehmen an Krebsimpfstoffen auf dieser Technologiebasis. Der Begriff „Impfstoff“ ist hierbei jedoch nur bedingt sinnvoll, da es sich im Gegensatz zu Infektionskrankheiten nicht um prophylaktische Impfungen handelt. Vielmehr soll das Immunsystem des Krebspatienten nach der Diagnose auf den vorhandenen Tumor trainiert werden. Im Fall der individualisierten Krebsimpfstoffe („iNeST“) von BioNTech werden im Rahmen einer Biopsie tumorspezifische mutierte Proteine identifiziert und dem Patienten darauf basierende, maßgeschneiderte mRNA verabreicht.

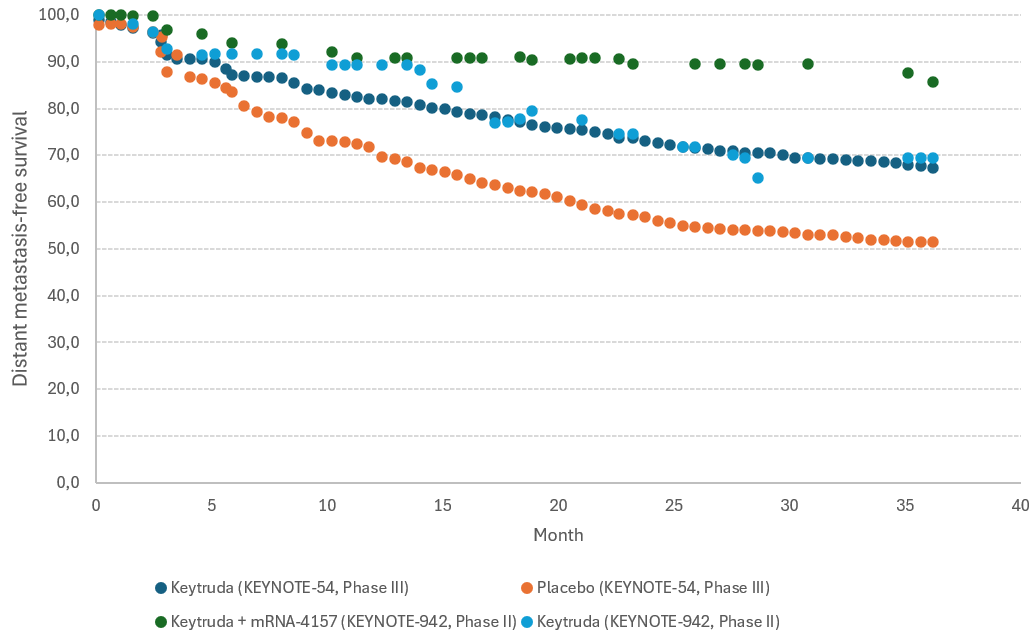
Dieser individuell zugeschnittene Impfstoff produziert im Körper dann für eine begrenzte Zeit Proteine mit der Signatur des Tumors. So soll das Immunsystem auf das Vorhandensein des eigenen Tumors sensibilisiert werden. Ob dieser Ansatz allein als Monotherapie Erfolg haben wird, ist angesichts der bereits ausgeführten Schutzmechanismen der Tumore noch offen. In Kombination mit Checkpoint-Inhibitoren wird diesem Ansatz aber großes Potenzial zugemessen: Der Krebsimpfstoff alarmiert das Immunsystem auf das Vorhandensein eines Tumors, während der Checkpoint-Inhibitor verhindert, dass der Tumor die T-Zellen deaktivieren kann. Die klinischen Studien von BioNTech befinden sich in diesem Bereich noch in der Phase II. Die bisher vorliegenden frühen Daten sind aber vielversprechend. Wettbewerber Moderna verfolgt im Bereich der Krebstherapien einen ähnlichen Ansatz und hat bereits Daten aus einer randomisierten Phase II veröffentlicht, die auf deutliche Synergien beim Einsatz von mRNA-Krebsimpfstoffen in Kombination mit Checkpoint-Inhibitoren (grüne Punkte) im Vergleich mit Checkpoint-Inhibitoren allein (blaue Punkte) hindeuten:
Der Kombination mit Immunmodulatoren wie Checkpoint-Inhibitoren wird also eine zentrale Rolle zukommen. Bisher wird dieser Markt durch den anti-PD1-Antikörper Keytruda, dem gegenwärtig umsatzstärksten Medikament weltweit, dominiert. Genau diesen Bereich könnte BioNTech nun mit dem Kandidaten BNT327 aufmischen.
BNT327 (PD-L1xVEGF bispezifischer Antikörper)
Das sowohl klinisch wie kommerziell aktuell vielversprechendste Medikament trägt den Programmnamen BNT327. Es handelt sich dabei um einen bispezifischen Antikörper, also einen Antikörper, der sich gleichzeitig gegen zwei Ziele in der Tumormikroumgebung richtet. Dies ist zum einen PD-L1, der bereits vorgestellte Immun-Checkpoint. Daneben zielt der Antikörper aber auch auf VEGF, den Vascular Endothelial Growth Factor, ab. Wie PD(L)1 ist auch VEGF ein bereits validiertes Ziel in der Onkologie. Da Krebszellen eine erhöhte Zellteilung aufweisen, benötigen sie auch eine ausgeprägte Versorgung mit Blutgefäßen; genau dafür ist der Vascular Endothelial Growth Factor zuständig. Die Hemmung von VEGF mittels eines Antikörpers kann die Versorgung des Tumors unterbinden.

Wie im Fall von PD-(L)1 gibt es auch bereits gegen VEGF gerichtete monoklonale Antikörper, in diesem Fall den Blockbuster Avastin von Roche. Dennoch kam kein westliches Pharmaunternehmen auf die Idee, PD-L1 und VEGF in einem Antikörper zu vereinen. Diese Innovation kam in diesem Fall aus China, genauer aus dem Hause Biotheus, das einen PD-L1xVEGF bispezifischen Antikörper entwickelte. BioNTech erkannte das Potenzial lange vor den meisten größeren Pharmaunternehmen und sicherte sich im November 2023 die Rechte an BNT327 (damals: PM8002) für den überschaubaren Betrag von 55 Mio. $. Seitdem sorgen BioNTech und dessen Mitwettbewerber Summit Therapeutics, die einen ähnlichen Antikörper ebenfalls aus China einlizenzierten, mit klinischen Daten für Aufsehen, die eine Verbesserung der PD-(L)1xVEGF-Klasse über die PD1-Antikörper um Platzhirsch Keytruda hinaus nahelegen. Zwar stehen globale, randomisierte Phase-III-Studien noch aus, aber zumindest die bisher vorliegenden Phase-II-Daten scheinen eine deutliche Sprache zu sprechen. Bei Patientinnen mit metastasiertem triple-negativem Brustkrebs (TNBC) etwa wurde mit BNT327 eine 18-monatige Überlebenswahrscheinlichkeit von 72,2 % erzielt, während der Goldstandard Keytruda in einer Zulassungsstudie auf 47,8 % kam:

Die Vergleichbarkeit der Studien steht jedoch unter dem Vorbehalt, dass die Keytruda-Daten aus einer deutlich größeren Phase-III-Studie mit weltweiter Patientenpopulation stammen. Auch bei anderen Krebsarten wie beispielsweise nicht-kleinzelligen Lungenkarzinom (NSCLC), der kommerziell größten Krebsindikation, zeigt BNT327 in einer Frühphasenstudie mit einer signifikanten Erhöhung des progressionsfreien Überlebens (PFS von 13,6 Monaten) vielversprechende erste Signale gegenüber dem von Keytruda in der Zulassungsstudie erzielten PFS von 7,7 Monaten. Das Unternehmen muss diese Daten in den nun gestarteten globalen Phase-III-Studien allerdings erst noch replizieren. Bis dahin besteht Grund für eine gesunde Skepsis, auch wenn PD-(L)1xVEGF bispezifische Antikörper inzwischen in mehr als zehn klinischen Studien an über 1.000 Patienten mit positiven Ergebnissen getestet wurden.
Die Investmentbank Wells Fargo schätzt das jährliche Umsatzpotenzial für dieses Klasse von bispezifischen Antikörpern im optimistischen Fall auf bis zu 100 Mrd. $. Die Analysten argumentieren, dass neben dem heutigen PD1-Checkpoint-Inhibitor-Markt (rund 50 Mrd. $, davon die Hälfte Keytruda) auch weitere Patientenpopulationen erschlossen werden könnten. Beispielsweise scheinen nach der bisherigen Datenlage auch Patienten mit Tumoren, die nur geringe Mengen an PD-L1 aufweisen, auf die neuen Therapien anzusprechen. Für diese Patienten ist die aktuelle Generation von Checkpoint-Inhibitoren in der Regel nicht zugelassen. Wir können den Optimismus rund um BNT327 grundsätzlich gut nachvollziehen; letztendlich gilt es aber, die Ergebnisse der umfangreichen globalen Phase-III-Studien im direkten Vergleich mit Keytruda und Co abzuwarten. Weitere entscheidende Daten dürften in den nächsten Jahren vorliegen.
BNT323 (HER2 Antibody-Drug-Conjugates)
Trotz der Durchbrüche im Bereich der Immuntherapien werden Chemotherapien, mit denen in der Regel umfangreiche Nebenwirkungen einhergehen, in bestimmten Indikationen weiterhin alleinstehend oder in Kombination mit Checkpoint-Inhibitoren eingesetzt. In den letzten Jahren gab es große Fortschritte in der Entwicklung einer intelligenteren, weil gezielteren Art der Chemotherapie. Die Idee ist einleuchtend: Weshalb nicht die Selektivität von Antikörpern mit einer toxischen Chemo-Ladung4Sogenannte Zytostatika verbinden?
Wie eingangs beschrieben, weisen viele Brustkrebszellen das Protein HER2 auf, woraufhin Roche mit Herceptin (Trastuzumab) einen therapeutischen Antikörper entwickelte. Durch die Kombination dieses HER2-Antikörpers mit einer toxischen Chemo-Ladung soll die Chemo-Komponente direkt auf die Krebszellen gelenkt werden, anstatt sich wie im Fall typischer Chemotherapien im gesamten Körper zu verteilen. Diese Kombination eines Antikörpers via eines Linkers mit der Chemo-Ladung wird als Antibody-Drug-Conjugate (ADC) bezeichnet.
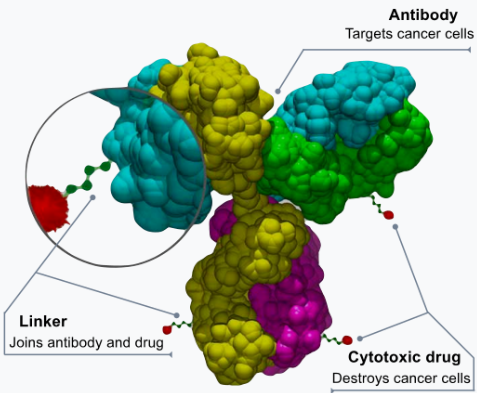
Der vielversprechendste bereits zugelassene ADC kommt mit Enhertu aus dem Hause AstraZeneca. Enhertu basiert auf dem HER2-Antikörper Trastuzumab, der mit dem zytotoxischen Deruxtecan verbunden wurde. In einigen Indikationen konnte dieser ADC bereits chemotherapeutische Ansätze als Standardtherapie ablösen, wie beispielsweise die untenstehenden Überlebensdaten bei einer Form von fortgeschrittenem Brustkrebs verdeutlichen:

Analysten gehen inzwischen von bis zu 10 Mrd. $ Jahresumsatz für Enhertu über diverse Brustkrebs-Indikationen aus. Doch das Medikament ist kein Wundermittel, denn der hohe Wirkungsgrad wird teilweise mit lebensbedrohlichen Nebenwirkungen wie interstitiellen Lungenerkrankungen erkauft. Genau hier versucht BioNTech anzusetzen und erwarb im Frühjahr 2023 für 170 Mio. $ die Rechte an BNT323 (vormals: DB-1303), ebenfalls ein HER2-ADC, der sich aber unter anderem durch die verwendete Linker-Technologie differenziert. Erste Ergebnisse aus Phase-I/II-Studien deuten darauf hin, dass BNT323 in der Tat ein vorteilhaftes Nebenwirkungsprofil aufweisen könnte, insbesondere interstitielle Lungenerkrankungen traten kaum auf. Diese Daten müssen sich nun in großangelegten Phase-III-Studien bestätigen. Hierzu wurden bereits zwei Studien gestartet, mit deren Ergebnissen in den nächsten 12 bis 18 Monaten zu rechnen ist. Für BioNTech ist dieses Medikament nicht nur als Monotherapie aufgrund des großen Endmarkts relevant, sondern auch, weil Antibody-Drug-Conjugates in der Zukunft sinnvolle Kombinationskandidaten mit anderen hauseigenen Modalitäten wie den Immunmodulatoren und den mRNA-Krebsimpfstoffen darstellen könnten. Erste Studien zur Kombination der ADCs mit BNT327 (PDL1xVEGF bispezifischem Antikörper) wurden jüngst gestartet.
Wird das zweite Kapitel gelingen?
Gegenwärtig ist noch offen, ob BioNTech auch in der Onkologie der Durchbruch gelingen wird. Das Unternehmen hat in den vergangenen Jahren sowohl eigene Medikamente in der klinischen Entwicklung vorangetrieben als auch zu vernünftigen Bewertungen externe Wirkstoffe einlizenziert, die sich potenziell synergistisch kombinieren lassen. Aus den bisher vorgelegten klinischen Phase-I- und II-Daten lassen sich noch keine finalen Rückschlüsse ziehen, doch scheint das Unternehmen in kommerziell großen Indikationen reale Chancen auf Erfolg zu haben. Die gleichzeitige Entwicklung derart vieler Medikamente ist jedoch teuer: BioNTech investiert im Jahr 2024 rund 2,5 Mrd. € in Forschung und Entwicklung. Für ein Biotechunternehmen ist BioNTech aber in einer einzigartigen Position: So verfügen die Mainzer zum einen über fast 20 Mrd. $ an liquiden Mitteln5Per Zwischenabschluss zum dritten Quartal 2024, inklusive kurzfristiger Forderungen gegenüber Pfizer. und können zum anderen aller Voraussicht nach auch über die nächsten Jahre mit Einnahmen aus dem COVID-19-Impfstoff Comirnaty im niedrigen einstelligen Milliardenbereich rechnen. Es ist daher davon auszugehen, dass BioNTech nur einen Teil des substanziellen Kassenbestands für die klinischen Entwicklungen verwenden muss.
Am Markt ist BioNTech aktuell mit 27 Mrd. $ bewertet, dem stehen der Kassenbestand, die COVID-19-Einnahmen und der potenzielle Wert der Pipeline gegenüber. Ob die Vision eines Immunonkologie-Powerhouse am Rhein aufgeht, werden die nächsten Jahre zeigen – die Puzzleteile rücken jedoch immer enger zusammen.
- 1Die finale Anzahl an Proteinformen übersteigt diese Zahl durch Prozesse wie alternatives Spleißen und posttranslationale Modifikationen um ein Vielfaches.
- 2Insbesondere zytotoxische T-Zellen, auch CD8-Lymphozyten genannt.
- 3Eingebettet in einem Lipid-based nanoparticle (LNP).
- 4Sogenannte Zytostatika
- 5Per Zwischenabschluss zum dritten Quartal 2024, inklusive kurzfristiger Forderungen gegenüber Pfizer.